Qu'est-ce qu'un changement d'état ?
Exemple : L'eau dans la nature
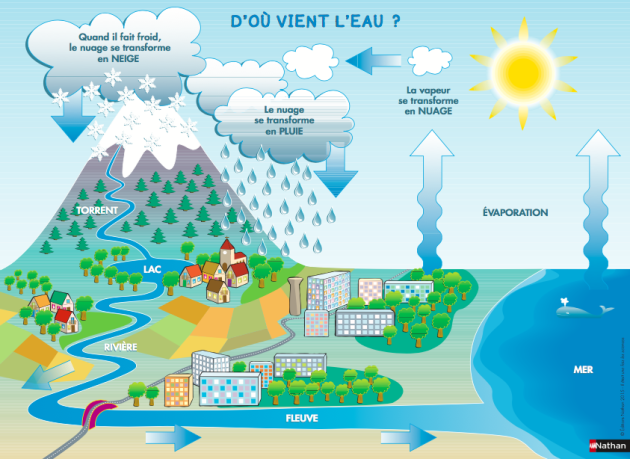
Le cycle de l'eau est un processus naturel qui se déroule en plusieurs étapes :
- Au niveau des océans, des rivières des lacs, .... l'eau liquide s'évapore,
- Quand la vapeur d'eau obtenue monte dans l'atmosphère, sous l'effet de la diminution de température, elle se refroidit et se liquéfie en fines gouttelettes : c'est la formation des nuages,
- Lorsque les nuages sont saturés en eau : l'eau retombe sous forme de précipitations,
- Si la température baisse davantage, les nuages peuvent passer à l'état solide : l'eau retombe sous forme de neige, qui va finir par fondre,
- Cette eau qui retombe sur le sol emprunte trois voies pour retourner à son point initial : le ruissellement en suivant le relief, l'infiltration dans les sols et à travers les roches ou la percolation, en migrant lentement à travers les sols.
Le cycle peut alors recommencer...
Au cours de ce cycle, l'eau peut se trouver à l'état solide (neige), liquide (mer, rivière, nuage) ou gazeux (vapeur d'eau). En fonction des conditions externes, notamment de la température, elle se passe d'un état à un autre.
Définition :
Un changement d'état est le passage d'un échantillon de matière d'un état à un autre.
La nature des entités étant inchangée, il s'agit d'une transformation physique.
Sur l'image ci-dessus, deux critiques sont à faire :
- Il est fait mention de l'eau uniquement. Or n'importe quelle espèce peut changer d'état.
- Le dessin proposé pour l'état de vapeur laisse à penser que la vapeur d'eau est visible.
Fondamental :
Un changement d'état dépend des conditions de température et de pression externes.
Par exemple, à la pression de 1013 hPa (pression normale), l'eau se solidifie ou fond à 0°C.
Un changement d'état a lieu lorsque la matière échange de la chaleur avec le milieu extérieur.
Exemple :
La carboglace (dioxyde de carbone solide en dessous de - 79°C) se transforme directement en gaz lorsqu'elle est placée à température ambiante. Il s'agit de la sublimation.
Les gouttelettes liquides obtenues sur le couvercle de la casserole sont issues de la liquéfaction de la vapeur d'eau obtenue après ébullition de l'eau. La liquéfaction est le passage de l'état gazeux à l'état liquide (à noter : concernant la liquéfaction, il est admis d'employer le terme condensation liquide).
L'aluminium fond à une température de 660°C. La fusion est le passage de l'état solide à l'état liquide.
Exemple : Pourquoi les canalisations risquent-elles d'éclater en hiver ?
Réalisons l'expérience suivante :
Observations | La masse d'eau, à l'état liquide ou à l'état solide, est de 45 g alors que le volume d'eau est passé de 45 mL à l'état liquide à 50 mL à l'état solide. |
Interprétation | Au cours de la solidification, il y a conservation de la masse d'eau mais augmentation de son volume. |
En hiver, sous l'effet des basses températures, l'eau s'est solidifiée : son volume a augmenté, ce qui a fait éclater le tuyau.
Attention :
Le volume augmente au cours de la solidification uniquement dans le cas de l'eau. Plus généralement, le volume d'un échantillon de matière diminue au cours de la solidification.
Fondamental :
Au cours du changement d'état d'un échantillon de matière, il y a conservation de la masse. En revanche, le volume est modifié.
En effet, le nombre de molécules contenues dans l'échantillon reste inchangé mais les molécules étant liées différemment selon que la matière est à l'état solide ou à l'état liquide, la place qu'elles occupent est différente.